Bei Einsendungen von Untersuchungsmaterial zur mikrobiologischen oder mykologischen Untersuchung müssen zusätzlich zu den üblichen Daten folgende Angaben übermittelt werden:
- Art und Entnahmeort des Untersuchungs-Materials
- Datum und Zeitpunkt der Entnahme
- (Verdachts-)Diagnose
- Erkrankungsbeginn
- Antimikrobielle, antibiotische oder antimykotische Therapie
Folgende Materialien stellen wir auf Anforderung kostenlos zur Verfügung. Wir bitten um genaue Beachtung der jeweils mitgegebenen Entnahmevorschriften. Die Verwendung dieser Probengefäße ist im Interesse einer sicheren Diagnostik unbedingt erforderlich.
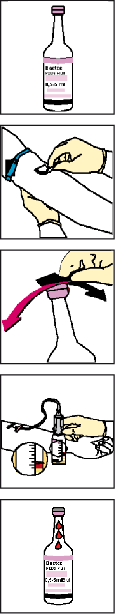
- Blutkulturflaschen mit Entnahmeanleitung
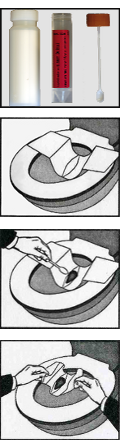
- Abstrichtupfer mit Transportmedium (Gel) für Bakterien und Pilze (Plastikröhrchen mit Transportmedium und Wattetupfer, steril verpackt)
- Trockener Tupfer für Schnelltest auf Streptokokken der Gruppe A, PCR-Untersuchungen
- Urikult (Eintauchnährmedien, dip-slides) für Urin
- Urin- und Sputumgefäße (auch für Punktate geeignet), steril
- Spezial-Objektträger zum Nachweis von Herpes simplex-Viren I/II (IFT)
- Stuhlgefäße zum Nachweis pathogener Darmkeime und Wurmeier
- Roche-Amplicor-Besteck für PCR-Nachweis (Chlamydien / Gonokokken)
- Spezialtransportmedium für DNA-Sondentechnik HPV
- Spezialnährböden für Sonderuntersuchungen (auf Anfrage)
- Transportgefäß für Magennüchternsekret auf Mykobakterium tuberculosis (mit Puffer)
- Spezielle Citratröhrchen auf Mykobakterien-Kultur aus Blut